L'Intelligenza Artificiale (AI) include varie tecnologie come modelli statistici, algoritmi e sistemi automodificanti. Queste tecnologie vengono sempre più applicate in tutte le fasi del ciclo di vita di un medicinale: sviluppo preclinico, registrazione e analisi dei dati degli studi clinici, farmacovigilanza, ottimizzazione dell'uso clinico e così via.
Le intelligenze artificiali e la loro vasta gamma di applicazione portano con sé, però, alcune sfide normative, come:
- la trasparenza degli algoritmi e il loro significato
- i rischi di guasti dell'AI
- l'impatto dei guasti dell'AI sullo sviluppo dei farmaci e sulla salute dei pazienti
I sistemi di AI sono, infatti, “non-deterministici”, cioè i loro risultati non sono esattamente prevedibili tramite formule e gli algoritmi vengono adattati automaticamente per massimizzare la correlazione tra dati in ingresso e in uscita. Questi sistemi hanno una fase di apprendimento in cui utilizzano dei set di dati e la corrispondenza tra risultati per poter “tarare” i parametri del modello matematico che sta al cuore del sistema. Successivamente, durante la fase di utilizzo vero e proprio del sistema, vengono inseriti i dati e si ottiene la previsione dei risultati. In questa fase, alcuni sistemi vengono continuamente addestrati per aggiornare i parametri del modello matematico.
Si fa comunque molta fatica a trovare una definizione unica di AI, come ribadisce anche EMA nel suo recente report su questo argomento.
L’INTELLIGENZA ARTIFICIALE SECONDO EMA
Nel report Informal Innovation Network - Horizon Scanning Assessment Report - Artificial Intelligence, emesso il 6 Agosto 2021 dall’ICMRA (International Coalition of Medicines Regulatory Authorities), gruppo guidato da EMA (European Medicine Agency), l’Intelligenza Artificiale è un argomento ampio che comprende algoritmi iterativi di "apprendimento" che utilizzano (big) data e un'elevata potenza di calcolo per effettuare interpretazioni, previsioni o decisioni in modo autonomo o semi-autonomo come ad imitazione di un comportamento intelligente.
<<Artificial intelligence is a broad term to encompass iterative, ‘learning’ algorithms that utilise (big) data and high computing power to make interpretations, predictions or decisions in an autonomous or semi-autonomous fashion that could be seen to imitate intelligent behaviour.>>
1.3 Artificial intelligence – ICMRA, Informal Innovation Network - Horizon Scanning Assessment Report - Artificial Intelligence
I sistemi di Intelligenza Artificiale possono esistere solo nel software (ad es. software di analisi delle immagini, motori di ricerca, sistemi di riconoscimento dei soggetti) o possono essere incorporati in dispositivi hardware e interagire con il mondo fisico (ad es. robot, macchine, applicazioni di sensori).
La diversità di metodi e applicazioni non permette di fornire un unico standard e una definizione concordata di Intelligenza Artificiale.
<<The diversity of methods and applications of AI means there is no single agreed standard and definition of AI at this time.>>
1.3 Artificial intelligence – ICMRA, Informal Innovation Network - Horizon Scanning Assessment Report - Artificial Intelligence
Il Machine Learning (ML) è uno dei modelli di AI prevalentemente utilizzati. È un metodo di calcolo per "apprendere" o derivare regole o schemi senza che questi ultimi siano esplicitamente programmati. Un esempio è il testo predittivo in uno smartphone: lo smartphone è pre-programmato con una serie di regole, ma ne apprende di nuove mentre l'utente scrive le stesse parole ripetutamente nel tempo.
MACHINE LEARNING SECONDO ISPE GAMP
A proposito di ML, l’Appendix S1 della ISPE GAMP RDI Good Practice Guide: Data Integrity by Design prende in esame la data integrity riguardo ai dati processati da questa tecnologia.
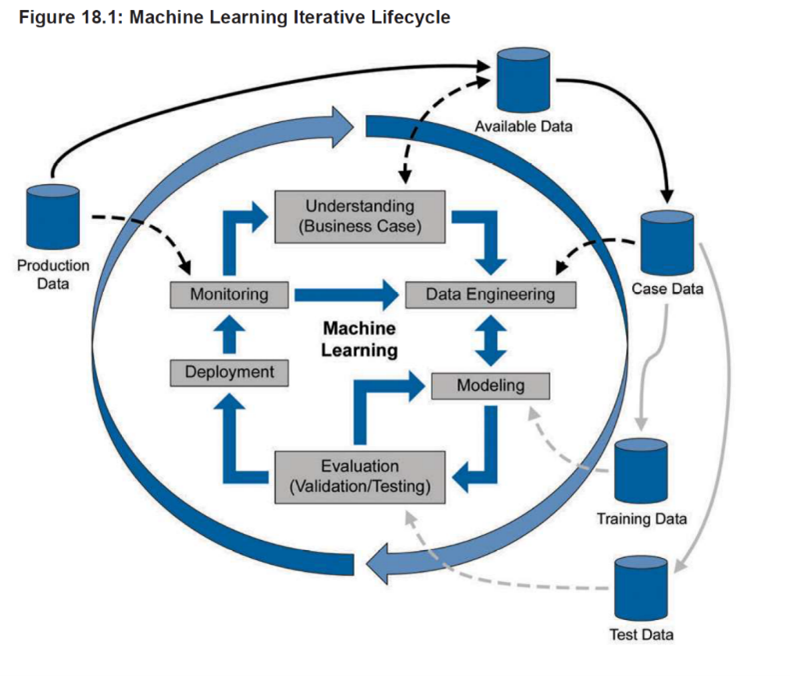
Figura 1: ciclo di vita Machine Learning, Appendix S1, ISPE GAMP
In questa GPG (Good Practice Guide) viene riportato anche il ciclo di vita iterativo di un ML (Figura 1) che si compone di 3 fasi:
1) Fase di concept (Understanding the Business Case)
Consiste nel comprendere i problemi da affrontare con la AI e nello sviluppare uno use case. L’obiettivo è quello di costruire un set di dati basato su ciò che l’azienda vuole ottenere, selezionando le informazioni utili ed escludendo quelle irrilevanti.
2) Fase di progetto (Data Modeling e Evaluation)
Viene selezionato un modello in base alle risposte che si vogliono ottenere (ad esempio classifiche, previsioni, fuori limite…). Una volta configurati sia il modello che l’algoritmo, la macchina può iniziare ad “imparare” usando il set di dati selezionati nella fase precedente. Una parte di questi dati viene utilizzata per testare e validare la macchina.
3) Fase operativa (Deployment e Monitoring)
In questa fase è possibile integrare e arricchire i modelli esistenti con nuovi dati, sviluppare nuovi modelli e stabilire un monitoraggio della performance per valutarne l’efficacia. Importanti in questa fase sono anche il Risk Management e il Change Management.
AMBIENTE REGOLATO: FDA-MHRA-HEALT CANADA
Anche FDA (U.S. Food and Drug Administration), Health Canada e MHRA (United Kingdom’s Medicines and Healthcare products Regulatory Agency) si sono recentemente espresse sulle AI con l’emissione del recente documento Good Machine Learning Practice for Medical Device Development: Guiding Principles (Ottobre 2021).
Nel documento, vengono elencati 10 principi guida con lo scopo di gettare le basi per lo sviluppo delle buone pratiche di apprendimento automatico (GMLP - Good Machine Learning Practice). Questi principi guida aiuteranno a promuovere dispositivi medici sicuri, efficaci e di alta qualità, fondati sull’utilizzo dell'Intelligenza Artificiale e l'apprendimento automatico.
I 10 principi, di seguito elencati, potrebbero essere utilizzati per adottare buone pratiche già messe in atto in altri settori o per crearne delle nuove:
- Usare una competenza multidisciplinare per tutto il Life Cycle del prodotto. Il principio richiede una conoscenza completa e approfondita dell'integrazione del dispositivo nel workflow clinico e dei rischi e benefici associati ad esso.
- Implementare buone pratiche di sicurezza e di software engineering.
- Nei test clinici, impiegare partecipanti e data set rappresentativi della popolazione di pazienti designata.
- Utilizzare data set di addestramento dell'AI diversi da quelli di test.
- Utilizzare data set di riferimento basati sui migliori metodi disponibili.
- Costruire il design del modello su misura dei dati disponibili e dell'intended use del dispositivo.
- Porre il focus sulla performance del team Umano-AI. Quando l'intervento umano è parte del ciclo di attività del modello ("human in the loop"), è necessario tenere in conto considerazioni sul fattore umano e sull'interpretabilità degli output del modello. In altre parole, è opportuno valutare la performance della coppia modello + operatore umano come team, piuttosto che la performance isolata del modello.
- Dimostrare, attraverso i test, la (buona) performance del dispositivo entro le rilevanti condizioni cliniche.
- Fornire agli utenti informazioni chiare ed essenziali. Le informazioni devono includere: l'intended use del prodotto, la performance del modello per ciascun sottogruppo di pazienti, le caratteristiche dei dati usati per addestrare e testare l'AI, gli input accettabili, le limitazioni note, l'interpretazione dell'interfaccia utente e l'integrazione del modello nel workflow clinico.
- Mantenere monitorata la performance e gestire i rischi dei modelli impiegati.
AMBIENTE REGOLATO: EMA
Tornando al rapporto dell’ICMRA, citato all’inizio di questo articolo, questo fornisce raccomandazioni utili alle Autorità regolatorie per affrontare l’introduzione dell’Intelligenza Artificiale in campo regolatorio, a livello globale.
Una parte del rapporto è dedicata all’esercizio di scansione dell’orizzonte (horizon-scanning) relativo all’Intelligenza Artificiale applicata allo sviluppo di farmaci e terapie avanzate, con lo scopo di misurare l’adeguatezza dei quadri normativi esistenti e suggerire adattamenti del sistema regolatorio alla medicina innovativa.
Di seguito, le principali raccomandazioni:
- Gli Enti Regolatori potrebbero dover applicare un approccio basato sul rischio per valutare e regolamentare l'AI.
- Gli sponsor, gli sviluppatori e le aziende farmaceutiche dovrebbero istituire strutture di governance rafforzate per supervisionare algoritmi e implementazioni di Intelligenza Artificiale che sono strettamente collegati al beneficio/rischio di un medicinale
- Dovrebbero essere sviluppate linee guida normative per lo sviluppo, la convalida e l'uso dell'AI con i medicinali riguardo a provenienza dei dati, affidabilità, trasparenza, farmacovigilanza, ecc…
L'attuazione delle raccomandazioni sarà discussa dai membri dell'ICMRA nei prossimi mesi.
Cover designed by @Freepik
Articolo a cura di
Alice Germani, Marketing Specialist Adeodata
Fonti
EMA, Artificial intelligence in medicine regulation
ICMRA Informal Innovation Network - Horizon Scanning Assessment Report - Artificial Intelligence
FDA, MHRA, Healt Canada, Good Machine Learning Practice for Medical Device Development: Guiding Principles